Zurück
Nitrat, Nitrit und Nitrosamine in der Umwelt
Chemischer Zusammenhang:
Stickstoff kommt in allen Oxidationsstufen zwischen +5 und -3 vor. Am stabilsten ist der gasförmige Stickstoff. Die Nitrat- und Nitritionen sind sehr gut wasserlöslich und mäßig giftig. N- Nitrosamine sind extrem giftig. Alle nachfolgend aufgeführten Reaktionen finden in der Natur statt.
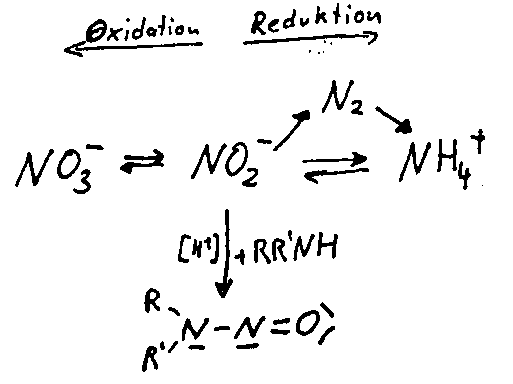
Vorkommen von Nitrat und Nitrit
Nitrat und Nitrit kommen fast überall vor, da die Pflanze sie zur Darstellung ihrer Aminosäuren.. benötigt. 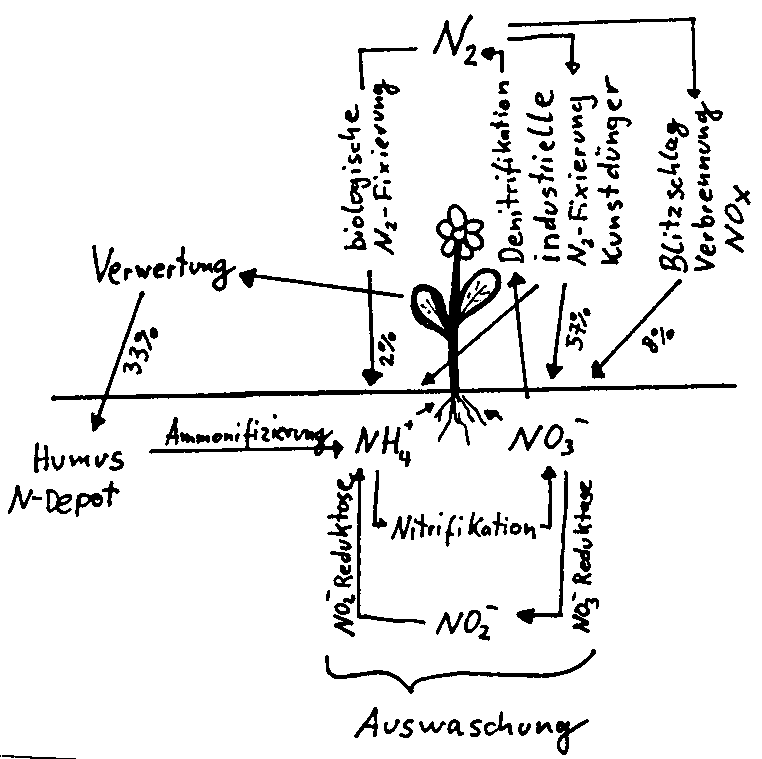 Im Stickstoffkreislauf durchläuft der Stickstoff normalerweise folgende Stationen: Pflanze, Verwertung, Humus, Ammonifizierung. Zusätzlich kann Stickstoff aus der Atmosphäre in den Kreislauf eingeführt oder daraus abgegeben werden. Die wasserlöslichen Ammonium- und Nitrationen können ineinander umgewandelt , oder in das Grundwasser ausgewaschen werden.
Im Stickstoffkreislauf durchläuft der Stickstoff normalerweise folgende Stationen: Pflanze, Verwertung, Humus, Ammonifizierung. Zusätzlich kann Stickstoff aus der Atmosphäre in den Kreislauf eingeführt oder daraus abgegeben werden. Die wasserlöslichen Ammonium- und Nitrationen können ineinander umgewandelt , oder in das Grundwasser ausgewaschen werden.
Dort können dann Nitratkonzentrationen bis über 300mg/l auftreten. Sauberes Oberflächenwasser und Trinkwasser enthält normalerweise 5..10mg/l . In der Nahrung tritt Nitrat besonders in Gemüse auf. Gründe hierfür sind Überdüngung, die von Licht und Molybdän abhängige Nitratreduktase, Trockenheiten.. . In Rote Beete wurden bis zu 3000mg/kg gemessen. Die durchschnittliche tägliche Belastung liegt bei 50..100mg/Tag, in Babynahrung dürfen höchstens 250mg/kg enthalten sein.
Hauptquellen für die Nitritbelastung sind vor allem die Verwendung von Nitritpöckelsalz für Fleisch und Käse. Auch bei zu langer Lagerung von nitrathaltigem Gemüse können Nitrite entstehen. Eine weitere Belastung durch Nitrit entsteht durch die Reduktion von Nitrat im Speichel durch Bakterien .Die durchschnittliche tägliche Belastung addiert sich so auf ca. 3 (Nahrung) + 10 (Speichel) = 13mg/Tag.
Toxizität von Nitrat und Nitrit
Die Akute Toxizität, d.h. die letale Dosis (LD50) für gesunde Erwachsene beträgt beim Nitrat ca. 100..300 mg/kg Körpergewicht, beim Nitrit ca. 25..100mg/kg Körpergewicht. Die toxische Wirkung beruht auf der oxidierenden Wirkung des Nitrit. Dabei wird Hämoglobin zu Methämoglobin (Fe II zu FeIII) oxidiert. Besonders Säuglinge sind gefährdet, da sie weniger Häm. , leichter oxidierbares Häm. ,eine langsamere Methäm. Reduktion, und einen höheren Trinkwasserbedarf haben. Durch den Verlust an Häm. kommt es zu einem Sauerstoffmangel (Zyanose: Blaufärbung).
Eine Chronische Toxizität aufgrund der oxidativen Desaminierung von Nucleinbasen konnte nicht eindeutig belegt werden. (Problem: Nitosaminbildung überwiegt)
Vorkommen von Nitrosaminen
Nitrosamine entstehen überall dort, wo sekundäre Amine (in Ausnahmen auch tertiäre und quatäre), Nitrit (Nitrat, Stickoxide) zusammentreffen. Katalytisch wirksam sind ein pH von 3..4, div. Bakterien.. .Typische Quellen sind Fleisch, Bier (früher), Zigarettenrauch, Kosmetika (früher), Kühlschmieröle, Arzneimittel, Gewürze. Die Exogene Zufuhr (außerhalb des Körpers geblidet) wird auf ca. 1mg/Tag geschätzt. Dazu kommt noch eine ca. 10mal so große Endogene Belastung (im Körper (bes. Magen) aus Amin und Nitrit gebildet).
Toxizität von Nitrosaminen
Nitrosamine besitzen eine erhebliche Chronische Toxizität. 300 verschiedene sec. Amine wurden untersucht, wovon sich 80% als karzinogen herausstellte. Sie erzeugten bei allen Tierversuchen in fast allen Organen bösartige Tumore. Es besteht eine lineare Dosis- Wikungsbeziehung, so daß kein Grenzwert sondern nur eine Empfehlung von weniger als 1mg/Tag angegeben werden kann.
Vermutlich verläuft Wirkung über eine a-C- Hydroxyliering mit anschließender Bildung eines Carbeniumions das die DNA angreift und so eine Krebszelle erzeugt.
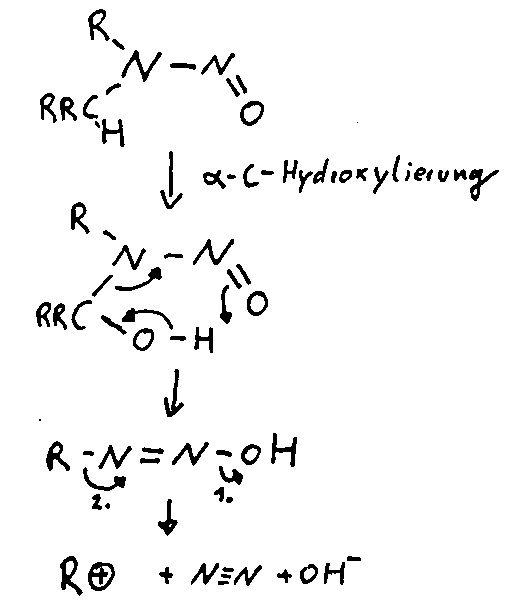


 Im Stickstoffkreislauf durchläuft der Stickstoff normalerweise folgende Stationen: Pflanze, Verwertung, Humus, Ammonifizierung. Zusätzlich kann Stickstoff aus der Atmosphäre in den Kreislauf eingeführt oder daraus abgegeben werden. Die wasserlöslichen Ammonium- und Nitrationen können ineinander umgewandelt , oder in das Grundwasser ausgewaschen werden.
Im Stickstoffkreislauf durchläuft der Stickstoff normalerweise folgende Stationen: Pflanze, Verwertung, Humus, Ammonifizierung. Zusätzlich kann Stickstoff aus der Atmosphäre in den Kreislauf eingeführt oder daraus abgegeben werden. Die wasserlöslichen Ammonium- und Nitrationen können ineinander umgewandelt , oder in das Grundwasser ausgewaschen werden.